Eine neu veröffentlichte Studie der RPTU Kaiserslautern-Landau zeigt, dass ein einzelner Eisen-Schwefel-Cluster für die ordnungsgemäße Ribosomenassemblierung in Zellen entscheidend ist. Diese Entdeckung erweitert unser Verständnis der Rolle von Metallionen bei der Proteinproduktion und Zellfunktion erheblich. Die in den Proceedings of the National Academy of Sciences veröffentlichten Ergebnisse zeigen, dass die Störung dieses Clusters die Ribosomenfunktion direkt beeinträchtigt und die Proteinsynthese stoppt.
Ribosomen und die Rolle von Metallionen
Ribosomen sind die zelluläre Maschinerie, die für die Bildung von Proteinen, den Arbeitspferden des Lebens, verantwortlich ist. Metallionen, insbesondere Eisen, spielen eine wichtige Rolle in zahlreichen biologischen Prozessen, einschließlich der Energieerzeugung und der DNA-Reparatur. Forscher der RPTU haben nun herausgefunden, dass ein spezifischer Eisen-Schwefel-Cluster für die Ribosomenassemblierung selbst essentiell ist.
Das Mak16-Protein und sein Eisen-Schwefel-Cluster
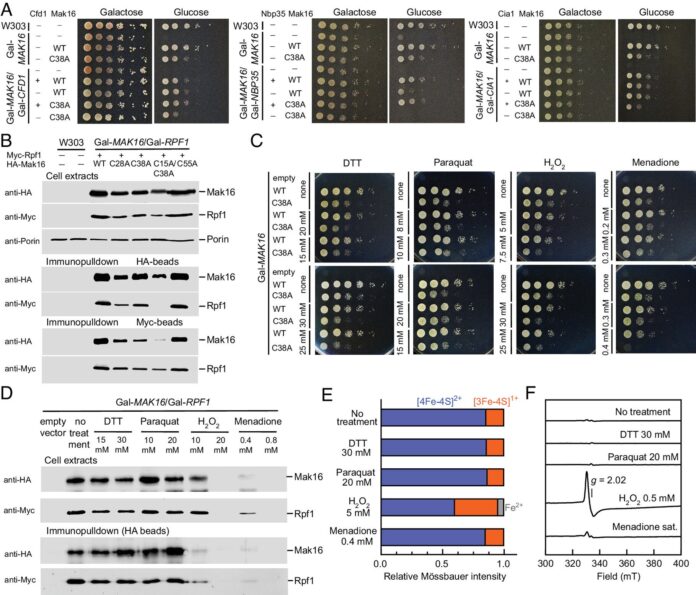
Die Studie konzentrierte sich auf das Mak16-Protein, eine Schlüsselkomponente bei der Ribosomenproduktion. Forscher fanden heraus, dass Mak16 nur dann stabil ist und ordnungsgemäß funktioniert, wenn es den [4Fe-4S]-Eisen-Schwefel-Cluster enthält – eine Struktur, die aus vier Eisen- und vier Schwefelatomen besteht, die in einem kubischen Muster angeordnet sind. Ohne diesen Cluster bricht die Ribosomenproduktion vollständig zusammen.
So funktioniert der Cluster
Mak16 enthält eine Tasche, die den [4Fe-4S]-Cluster an Ort und Stelle halten soll und durch vier Cystein-Aminosäuren stabilisiert wird. Das Forschungsteam erstellte modifizierte Versionen von Mak16 – eine mit dem intakten Cluster und eine ohne –, um die Bedeutung des Clusters zu demonstrieren. Mit einer Technik namens Immunpräzipitation zeigten sie, dass nur die intakte Version zuverlässig an sein Partnerprotein Rpf1 binden konnte.
Folgen der Cluster-Abwesenheit
Wenn der Cluster fehlt, können sich die Ribosomen nicht richtig zusammensetzen. Experimente mit Hefezellen bestätigten, dass die rRNA-Produktion und die Ribosomenreifung direkt vom Vorhandensein des [4Fe-4S]-Clusters in Mak16 abhängen.
Validierung der Identität des Clusters
Die Forscher verwendeten fortschrittliche spektroskopische Techniken, um die Zusammensetzung des Clusters zu bestätigen. Die Elektronenspinresonanzspektroskopie (EPR) zeigte das Vorhandensein von Eisenionen, während die Mössbauer-Spektroskopie genau analysierte, wie die Eisenatome innerhalb der Proteinstruktur gebunden sind.
Cluster-Sensitivität und zellulärer Stress
Der [4Fe-4S]-Cluster reagiert sehr empfindlich auf oxidativen Stress. Zerfällt es, stoppt die Ribosomenproduktion. Dies deutet darauf hin, dass der Cluster auch als Sensor fungiert und der Zelle signalisiert, wann die Proteinproduktion reduziert werden muss.
Implikationen für die Zellbiologie
Diese Entdeckung erweitert unser Verständnis darüber, wie Zellen die Proteinproduktion steuern und auf Stress reagieren. Störungen dieser Prozesse können zu Problemen bei der Proteinsynthese oder der Zellfunktion führen. Die Forschung unterstreicht die entscheidende Rolle von Metallionen bei grundlegenden zellulären Prozessen